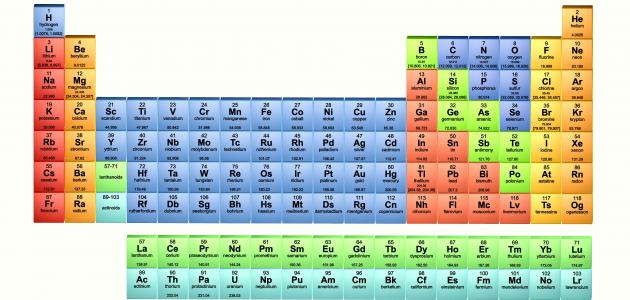
ماهو الجدول الدوري للعناصر الكميائية ؟
الجدول الدوري للعناصر الكيميائية أو جدول مندليف، هو جدول يحتوي علي العناصر الكيميائية التي تم اكتشافها والذي يساعد بشكل كبير على تحديد العدد الذري والتوزيع الإلكتروني لكل عنصر من العناصر، حيث تم ترتيب هذه العناصر في هذا الجدول بهذه الطريقة، فلقد تم توزيع هذه العناصر حسب الخواص الكيميائية الخاصة بكل عنصر، كما تم تقسيمها حسب طبيعتها أيضا من حيث كونها تنتمي الي الفلزات أو الغير فلزات.
لقد تم ترتيب الجدول حسب العناصر ومدى تشابهها مع بعضها البعض، حيث يحتوي الجدول الدوري على 118 عنصر مختلفين في بعض الخواص ومتشابهين في البعض الآخر، كما أنه يحتوي على ستة مجموعات والتي تساعد على توضيح التصنيفات الخاصة بالعناصر،فهو يعتبر من أهم الأساليب التي تساعد العلماء على التعرف على كل عنصر من العناصر وتكوينه الذري والكيميائي وذلك لتحديد طريقة التعامل معه والاستفادة منه في تكوين التفاعلات والتركيبات الكيميائية المختلفة.
لقد تم ترتيب الجدول بشكل دقيق جدا، حيث نكتشف أن عدد الإلكترونيات الخاص بالعناصر يزداد كلما تم الانتقال من عمود إلى آخر، كما تزداد عدد الذرات الخاصه بكل عنصر أيضا كلما انتقل من صف إلى آخر الأمر الذي سهل كثيرا التعامل مع الجدول وسهولة استيعابها وحفظها وخاصة لدي الطلاب، فيتم تطبيق هذا الجدول في الكتب بالمدارس ويلزم تفوق الطالب في التعامل مع المعادلات والتفاعلات الكيميائية المختلفة أن يقوم بفهم واستيعاب وحفظ هذا الجدول والعناصر التي تتواجد فيها بترتيبها وعددها الذري والالكتروني أيضا وكذلك طبيعتها وغيرها من الأمور الهامة التي يتضمنها هذا الجدول الدوري للعناصر الكيميائية.
الجدول الدوري الكيميائي هو واحدا من أهم الجداول التي تحتوي على العديد من العناصر الذرية والتي تم تحديد العدد الذري الخاص بكل عنصر وهذا ساعد بشكل كبير على تكوين التفاعلات الكيميائية والمعادلات بنجاح.
فالجدول الدوري لا يمكن الاستغناء عنه حيث يتم شرح فيه كل ما يخص كل عنصر من تكوين وترتيب وصفات تساعد في التكوينات الكيميائية والعلوم والفيزياء أيضا.
مراحل تطور الجدول الدوري للعناصر الكميائية
لقد سمي الجدول الدوري بهذا الاسم نسبة إلي أنماط العناصر المتكررة في كل عنصر من عناصر الجدول، فلقد تم نشر جدول مندليف أي الجدول الدوري للعناصر الكيميائية في عام 1869 ،ولم يكن جدول مندليف دقيقا حيث انه ترك ثلاث فراغات في الجدول بدون كتابه عناصر وذلك نظرا لرؤيته المستقبلية أنه سوف يتم اكتشاف عناصر جديدة سوف تدون في هذه الفراغات، ولقد قام مندليف بتوضيح خواص هذه العناصر والتي اكتشف بعد مرور حوالي 16 عام علي نشر الجدول.
بداية نشر جدول مندليف كان يعتمد علي توزيع العناصر وفقا للوزن الذري بحيث كان يحتوي علي 63 عنصر فقط من العناصر الذرية، ومع مرور الزمن جاء العالم مورلي والذي قام بترتيب الجدول حسب العدد الذري للعناصر وظل كذلك حتى تطور الجدول بالشكل الحديث والذي تم ترتيبه حسب العدد الذري وطريقة ملئ مستويات الطاقة بالالكترونات، فلقد تم تقسيمه إلى 18 مجموعة والتي تم ترتيب العناصر فيها من اليسار إلى اليمين ومن أعلى إلى أسفل حيث يزداد العدد الذري لكل عنصر من هذه العناصر.
يوجد في نهاية الجدول الدوري مجموعتين مقسمين الي نصفين، يحتوي كل صف منها على 14 عنصر وتسمى بعناصر الأرض النادرة حيث أنها تتشابه في الخواص، فلقد تم اكتشاف صعوبة كبيرة في الفصل بين هذه العناصر في حال اختلاطها سويا، وتسمى المجموعة باسم العناصر الانتقالية ويطلق على الصف الأول اسم اللانثانيدات والثاني يطلق عليه اسم الأكتينيدات.
يبدأ الجدول بعنصر الهيدروجين والذي يحتوي على عدد ذري واحد فقط، وتتبع العناصر زيادة في أعدادها الذرية حتي نصل الي نهاية الجدول الدوري الذي ينتهي بعنصر اوغانيسون والذي يحتوي على عدد الذري 118 .
يعتبر أول 98 عنصر من عناصر الجدول هي عناصر طبيعية تتواجد في الطبيعة، أما العناصر المتبقية في الجدول والتي تضم العناصر من 99 الى العنصر 118 فهي عناصر تم تركيبها في المختبر ومازالت الأبحاث جارية لاكتشاف باقي العناصر وتركيب العناصر الأخري لتكملة الجدول وذلك للاستفادة منها في الاختبارات والتفاعلات المختلفة سواء في الكيمياء أو الفيزياء أو العلوم المختلفة.
أهمية الجدول الدوري للعناصر الكميائية
لقد تم اكتشاف كل ماهو في الطبيعة لخدمة البشرية بشكل كامل والمجتمع والتطوير المستمر منه، ويعتبر الجدول الدوري واحدا من الاكتشافات الهامة جدا في مجال العلوم الكيميائية والفيزيائية، حيث يتم استخدام هذا الجدول في التعرف على حاله كل عنصر من العناصر التي تتواجد في الطبيعة أو التي تم اكتشافها الأمر الذي يساعد على تكوين المعادلات والتفاعلات الكيميائية بشكل صحيح وتقليل نسبة الخطأ، حيث يساعد هذا الجدول على معرفة طبيعة كل عنصر عدده الذري وكتلته وايضا صفاته وخواصه من حيث كونها فلزات أم غير فلزات وبالتالي يتم التعامل معها بالشكل الصحيح.
لقد تم توفير وتطبيق الجدول في المدارس وفي كتب الوزارة، حيث تم تطبيقها كمنهج أساسي لطلاب المرحلة العلمية وطلاب الكليات العلمية، حيث يتطلب معرفة رمز كل عنصر من العناصر الكيميائية وكذلك معرفة كتلته والعدد الذري لكلا منهم، حيث يمكن ذلك من معرفة سلوك كل عنصر من العناصر الكيميائية وبالتالي التنبؤ بالتفاعلات الكيميائية التي يستطيع العنصر أن يدخل فيها ولا يتم كل هذا إلا من خلال معرفة مكان كل عنصر في الجدول وتحديد مجموعته أيضا.
خواص العناصر التي تتواجد في الجدول الدوري
تختلف مسميات العناصر وأشكالها وطبيعتها وخواصها أيضا، ولقد تم ترتيب هذه العناصر في الجدول بطريقة تساعد بشكل كبير على سهولة حفظ هذه العناصر واستيعابها، ونجد أن لكل مجموعة من عناصر الجدول الدوري خواص تختلف عن المجموعات الأخرى، تتشابه خصائص عناصر المجموعة الواحدة بينما تختلف عن العناصر التي تتواجد في المجموعات الأخرى حيث انه وكما ذكرنا أن الجدول ينقسم إلى مجموعات مختلفة، وتنقسم هذه العناصر حسب خواصها الي :
- المجموعة الاولي
هي عناصر فلزات، تتمثل خواصها الفيزيائية في كونها تتمتع باللمعة الخاصة والبريق المميز والذي يلفت النظر ويجيب الانتباه، كما أنها من أكثر العناصر الموصلة للكهرباء والحرارة أيضا، وتتمتع هذه العناصر بالكثافة العالية وايضا درجة انصهار عالية.
اما الخواص الكيميائية لهذه العناصر فهي تتمثل في فقدانها للاكترونات بسهولة و تتعرض للتاكل والصدأ، ونجد ان جميع عناصر الفلزات صلبة ماعدا عنصر واحد وهو الزئبق والذي يتمتع بالحالة السائلة.
- المجموعة الثانية
عناصر لا فلزات، حيث تتمثل خواصها الفيزيائية في كونها لا تتمتع باللمعة أو البريق فهي مطفية، كما أنها غير جيدة التوصيل للكهرباء ولا تتأثر بالحرارة، تتعرض هذه العناصر الي الكسر والتلف بسهولة كما أن كثافتها منخفضة.
أما الخواص الكيميائية لهذه العناصر فهي تتمثل في كونها تكتسب المزيد من الإلكترونات، ونلاحظ أن خواص اللافلزات هي عكس لخواص الفلزات.
- المجموعة الثالثة
أشباه الفلزات …. تتمثل خواصها في كونها صلبة، كما تتواجد في حالة لامعة وأيضا غير لامعة، كما أن لديها القدرة على التوصيل للحرارة والكهرباء ولكن بكفاءة أقل من المعادن، حيث نلاحظ أن أشباه الفلزات تحتوي على خواص الفلزات واللافلزات أيضا.
خصائص الجدول الدوري للعناصر الكميائية:
يحتوي الجدول على 7 صفوف بينما يحتوي الجدول على 18 عمود، ويقل العدد الذري للعناصر في حال الانتقال من اليسار إلى اليمين فلقد تم ترتيب العناصر تصاعديا حسب العدد الذري لكل عنصر، كما نلاحظ أن لكل مجموعة من العناصر نفس التكافؤ فيمكن من خلال العدد الذري للعناصر أو عدد مستويات الطاقة يتم تحديد رقم الدورة الخاصة بالعنصر، كما يمكن من خلال عدد الإلكترونات تحديد رقم المجموعة الخاصة بها.
تنقسم مجموعات الجدول الى عدة مجموعات والتي تتمثل في مجموعات يمين الجدول ومجموعات يسار الجدول يفصل بينهما مجموعة من العناصر يطلق عليها اسم العناصر الإنتقالية، كما يوجد أيضا مجموعة تسمى المجموعة الصفرية وهي تتواجد في أسفل يمين الجدول وتسمى بالمجموعة الصفرية ويطلق عليها مجموعة الغازات الخاملة.
من أهم خواص العناصر التي تتواجد بالجدول الدوري أنها تقل في حجمها كلما ازداد عددها الذري، كما يوجد في نهاية كل مجموعة من مجموعات الجدول عنصر خامل يمتلئ مداره الأخير بعدد الإلكترونات، كما تتمتع عناصر المجموعات الرابعة والخامسة والسادسة بقدرتها على جذب الإلكترونات بينما تفقد عناصر المجموعة الاولي والثانيه والثالثه الكتروناتها، كما نلاحظ أن الجدول يحتوي علي مجموعة كبيرة من المعادن المختلفة والتي يطلق عليها اسم معادن قلوية وأخري ترابية ومعادن أساسية وانتقالية أيضا.
مستويات الطاقة في الذرة لكل عنصر بالجدول الدوري
الذرة هي وحدة أساسية لبناء المادة وهي أساس بناء العناصر، وتتكون الذرة من ثلاث جسيمات أصغر حجما، حيث يوجد بالذرة نواة موجبة الشحنة تتكون من بروتونات ونيوترونات ويحاط بها إلكترونات سالبة الشحنة، ويتم توزيع هذه الإلكترونات في مدارات أو مستويات تسمي بمستويات الطاقة، حيث يتم جذب هذه الإلكترونات إلى النواة موجبة الشحنة والذي يساعد علي اكتمالها.
مستويات الطاقة هي المدار الذي يحيط بالذرة ويتواجد فيه الإلكترونات والذي يرمز له بالرمز n ، حيث يستطيع المستوي الأول أن يتحمل الكترونان فقط وهو العدد الذي يتشبع به هذا المستوى، بينما يتحمل المستوى الثاني وتشبع بالكترونات تصل الي 8 الكترونات، كما يتحمل المستوى الثالث وتشبع بالكترونات تصل إلى 18 إلكترون، ويصل عدد الإلكترونات التي يتشبع بها المستوى الرابع إلى 32 إلكترون، وتزداد عدد الإلكترونات التي يتشبع بها كل مستوى من هذه المستويات الخاصة بالعناصر وذلك حسب المعادلة التالية ” س = 2 (ن)2 .
يتم توزيع الإلكترونات على المدارات حول النواة في ترتيب المسارات الآتية ” K,L,M,N,O,P,Q “، فمثلا عنصر الأرجون Ar 18 يتم توزيعها كالآتي المستوى الأول K يتشبع بها 2 إلكترون، المستوى الثاني L يتشبع ب 8 إلكترون، بينما المستوى الثالث M يتشبع ب 8 إلكترون وبهذا نكون قد قمنا بتوزيع عدد إلكترونات ذرة الارجون.
مكونات الجدول الدوري للعناصر الكميائية
لقد تم تصميم الجدول بشكل مبسط يساعد على سهولة فهمه والحصول علي العناصر بشكل سريع وتحديد مكانها، ويتكون الجدول من 7 صفوف أفقية تسمى بالدورات، حيث تم ترتيب العناصر فيه حسب الزيادة في العدد الذري فتبدأ كل دورة بذرة عنصر تحتوي على إلكترون واحد فقط وتنتهي بذرة تحتوي على إلكترونات يكتمل بها الغلاف التكافئي لها، ويحتوي اول صف علي عنصرين فقط، ويحتوي الصف التالي على 8 عناصر يليها الصف الثالث الذي يحتوي على 8 عناصر أيضا، وتسمي الثلاث صفوف الاولى بالدورات القصيرة نظرا لاحتوائها الي القليل من عدد العناصر.
تحتوي الدورة الرابعة على 18 عنصر وكذلك الدورة الخامسة التي تحتوي على نفس عدد العناصر، بينما تحتوي الدورة السادسة على 32 عنصر تليها الدورة السابعة التي تحتوي علي 22 عنصر فقط، ولقد سميت أغلب عناصر الدورة السابعة بالعناصر المشعة نظرا لكونها عناصر غير طبيعية.
بجانب ذلك نجد أن الجدول يحتوي على 18 عمود تنقسم الي 8 مجموعات رأسية و 10 مجموعات فرعية، يتم ترقيم هذه العواميد بارقام رومانية كما يوجد منها بأرقام عربية كما يتوافر طريقة الخلط بين الأرقام العربية والرومانية، ولقد تم اختيار الترقيم العربي لسهولة التعامل معها وحتى لا تتسبب في اي خطأ أثناء التعامل مع الجدول، ويتم تسمية كل عمود كالآتي :
- المجموعة الأولى 1A
تسمى بمجموعة العناصر الفلزات القلوية وهي عناصر لينة تشكل ايونات موجبة أحادية التفاعل وهي عناصر قوية، وتشمل هذه المجموعة العناصر الآتية ” Li ، Na ، K ، Rb ،Cs ، Fr ”
- المجموعة الثانية 2A
تسمى بمجموعة العناصر القلوية الترابية وهي عناصر أكثر صلابة وكثافة حيث تقوم بتكوين أيونات ثنائية الشحنة موجبة، وتشمل هذه المجموعة العناصر الآتية “Be ، Mg ، Ca ، Sr ، Ba ، Ra ”
- المجموعة الثالثة 3A
تسمى بمجموعة البورون وهي عناصر لها اكاسيد حماية وأخري قاعدية، كما تقوم بتكوين ايونات ثلاثيه الشحنة الموجبة، وتشمل هذه المجموعة العناصر الآتية ” B ، Al ، Ga ، In ، Tl”
- المجموعة الرابعة 4A
تسمى بمجموعة الكربون وهي تحتوي على عناصر فلزية وأيضا عنصر لا فلزي وعنصرين من أشباه فلزات، كما أنها تحتوي علي عناصر تميل للتأكسد، وتشمل هذه المجموعة العناصر الآتية ” C ، Si ، Ge ، Sn ، Pb ”
- المجموعة الخامسة 5A
تسمى بمجموعة النيتروجين وهي تحتوي علي عنصر فلزي وايضا عنصرين لا فلزي و عنصرين من أشباه فلزات، كما تتراوح حالات التأكسد في هذه المجموعة من -3 الى +5 ،وتشمل هذه المجموعة على العناصر الآتية ” N ، P ، As ، Sb ، Bi ”
- المجموعة السادسة 6A
تسمي بمجموعة الأكسجين وهي تحتوي على ثلاث عناصر لا فلزية وايضا عنصرين من أشباه الفلزات، وتشمل هذه المجموعة على العناصر الآتية ” O ، S ، Se ، Te ، Po ”
- المجموعة السابعة 7A
تسمى بمجموعة الهالوجينات وهي تحتوي على عناصر لا فلزية قوية تتفاعل بشدة مع الفلزات، فتعتبر جميع عناصر هذه المجموعة فعالة والبعض منها ذات صفات حامضية قوية، وتشمل هذه المجموعة علي العناصر الآتية ” F ، Cl ، Br ، I ، At ”
- المجموعة الثامنة
المجموعة الصفرية وتسمى بمجموعة الغازات النبيلة أو الخاملة وهي تحتوي على جزيئات أحادية الذرة، وتشمل هذه المجموعة على العناصر الآتية ” He ، Ne ، Hr ، Kr ، Xe ، Rn ”
مميزات الجدول الدوري للعناصر الكميائية
يعتبر الجدول من أهم الطرق التي سهلت بشكل كبير التعامل مع العناصر وتحديدها بشكل دقيق، فلقد تمكن العالم مندليف في تحقيق فائدة كبيرة من خلال نشر هذا الجدول الذي قام بتصنيف العناصر وتحديد نوع كلا منها وغيرها من الأمور التي تتعلق بالعناصر من حيث حالتها وتكوينها، فنجد العديد من المميزات التي أتاحها هذا الجدول والتي تتمثل في :
- سهل على الطلاب القدرة على تعلم العناصر الكيميائية وتكوين العناصر من ذرات وبروتينات والكترونات وتحديد نوعها من كونها فلزات أو غير فلزات وأشباه فلزات.
- يساعد على سهولة الحصول على العناصر والتعرف على خصائصها.
- ساعد العلماء بشكل كبير والباحثين أيضا في تسهيل تنفيذ تجاربهم المختلفة والقيام بالأبحاث.
- ساعد الجدول علي الحد من الوقوع في الخطأ للفهم لأي من العناصر حيث يوضح كل عنصر صفاته وخواصه.
- يدل على قوى الجذب بين العناصر للالكترونات حيث تزداد كلما اتجهنا الي اليمين في الجدول وتقل كلما اتجهنا الى الأسفل.
- يعبر عن نصف قطر ذرات العناصر حيث يزداد كلما اتجهنا إلى اليسار والنزول الى الأسفل.
- يقوم بترتيب العناصر حسب طاقة التأين الخاصة بها.
- يرتب العناصر بحسب العدد الذري بشكل عمودي وتسمى بالمجموعة، كما يرتب العناصر حسب عدد الإلكترونات بشكل أفقي وتسمى دورة.
هناك مجموعة من الأمور التي تم تطويرها في الجدول الدوري لمندليف، كما يوجد بعض الحقائق عن هذا الجدول والتي تتمثل في :
- تم تغيير ترتيب العناصر في الجدول الدوري الحديث بدلا من الترتيب حسب العدد الذري والذي لا يتمتع بالدقة.
- الاكتشاف المتزايد للعناصر مع مرور الوقت يؤدي إلي إعادة ترتيب الجدول الدوري.
- يعتبر الزئبق هو العنصر الوحيد الفلزي الذي يوجد في شكل سائل.
- بعض العناصر في الجدول الدوري تتحول إلي عناصر ثقيلة إذا تم تعرضها للتآكل الإشعاعي.
- يحتوي الجدول على عناصر طبيعية والتي عددها 90 عنصر والباقي تم تصنيعه في المعمل.
- يعتبر عنصر الفرنسيس من العناصر النادرة التي تتواجد بشكل قليل جدا في الطبيعة.
- يتميز كل عمود بأن عناصره تحتوي علي نفس عدد الإلكترونات في مستواها الأخير للطاقة.
يظل البحث مستمر عن العناصر الجديدة، فلقد قام مندليف بترك ثلاث فراغات في الجدول الدوري ذلك لكونه كان يدرك أن هناك عناصر سوف تكتشف وقام بتحديد خواصها والتي تم تحديدها فيما بعد وتم تدوينها في الجدول والتي تتمثل في سكانديوم ، جاليوم، جرمانيوم ، كما يوجد عناصر أخرى لم يتم اكتشافها بعد وهي تحت الاكتشاف.
عيوب الجدول الدوري للعناصر الكميائية
بالرغم من المميزات المتعددة التي يتضمنها الجدول الدوري والتي ساعدت بشكل كبير الطالب والباحث والعالم أيضا، إلا أن تصميم الجدول يتضمن مجموعة من العيوب والتي تكون واضحة في الجدول بشكل ملحوظ والتي تتمثل في :
- ترتيب عنصر الهيدروجين لم يكن دقيقا، فهو موضوع في بداية الجدول وهي قائمة الفلزات بالرغم من انه يحتوي علي خصائص قلوية.
- الشكل الغير منظم الذي تم تصميم الجدول به والذي يتمثل في اللانثانيدات والاكتنيدات حيث تم وضعهم في جدول خارج الجدول الأساسي.
- هناك العديد من العناصر والإعداد الذرية التي لم يتم اكتشافها بعد فهو لا يحتوي على كل العناصر.
- قام بوضع أكثر من عنصر في خانة واحدة مثل النيكل والكوبلت.
بالرغم من العيوب التي تتواجد في الجدول إلا أنه يعتبر من أحدث وأنجح الجداول، حيث تواجد العديد من المحاولات التي كانت تعمل على تنفيذه ونجاحه ولكنها باءت بالفشل، ولقد تم تطوير الجدول الدوري لمندليف حتى أصبح بالشكل الحالي والذي تتضمن على مميزات وأهمية كبيرة في التعامل الكيميائي والفيزيائي والعلمي أيضا.
لقد جاء موزلي بعد العالم مندليف والذي قام بتطوير الجدول الدوري بشكل آخر مختلف بعض الشئ عن مندليف، حيث استند موزلي علي أن دورية خواص العناصر تستند ترتبط بأعدادها الذرية وليس بالوزن الذري، فقام موزلي تقسيم العناصر الي مجموعتين فرعيتين هما A ، B وذلك لما قام باكتشافه من اختلاف في خواص كلا من هذه العناصر، كما تم إعادة ترتيب الجدول الدوري لاكتشاف العناصر الجديدة الأمر الذي لم ينتهي بعد والذي لا يزال مستمرا فهناك العديد من الأبحاث والتجارب التي يتم من خلالها اكتشاف العناصر الجديدة وتحديدها.
وأخيراً، شكرا لكم لقراءة المقال حتى النهاية، يمكنك قراءة المزيد من المقالات في مجال تطوير الذات من هنا.. مقدمة لكم من أكاديمية مجتهد.

