الجدول الدوري الحديث هو أداة هامة في مجال الكيمياء، وقد يعود تاريخه إلى القرن التاسع عشر. تم تطوير الجدول الدوري لتنظيم وتصنيف العناصر الكيميائية بناءً على خصائصها المشتركة. يساعد الجدول الدوري العلماء على فهم ودراسة تركيب العناصر وسلوكها الكيميائي.
تاريخ الجدول الدوري
في عام 1869، قام العالم الروسي ديمتري مندليف بتطوير الجدول الدوري الأول. كانت فكرته تعتمد على ترتيب العناصر بناءً على الوزن الذري. ولكن مع مرور الوقت، تم تطوير الجدول الدوري ليشمل عناصر جديدة ويستخدم ترتيبًا أفضل للعناصر التوضعية.
شاهد أيضًا: شرح الجدول الدوري للعناصر الكميائية
أهمية الجدول الدوري في الكيمياء
الجدول الدوري يعتبر أحد أدوات العمل الأساسية في مجال الكيمياء.وهنا بعض الأسباب التي توضح أهمية الجدول الدوري:
- 1. تصنيف العناصر: يقدم الجدول الدوري ترتيبًا منظمًا للعناصر الكيميائية بناءً على خصائصها. هذا التصنيف يساعد العلماء على فهم محددات العناصر وتمييزها من بعضها البعض.
- 2. العلاقات الكيميائية: يسمح الجدول الدوري للعلماء بتحليل العلاقات والمميزات الكيميائية بين العناصر. وهذا يفتح الأبواب للتوصل إلى فهم أفضل لطبيعة وخاصيات المركبات الكيميائية.
- 3. التوقعات الكيميائية: بفضل الجدول الدوري، يمكن للعلماء التنبؤ بسلوك العناصر الحديثة وكيفية تفاعلها مع العناصر الأخرى. هذا يساعد في توجيه الأبحاث والعمليات الكيميائية.
- 4. الإكتشاف العلمي: يمكن أن يفتح الجدول الدوري الباب أمام اكتشاف عناصر جديدة وفهم أفضل لخصائص العناصر المعروفة. قد يقود هذا الاكتشاف إلى تطوير تكنولوجيا وتطبيقات جديدة في مجالات مثل الصناعة والطب.
باختصار، الجدول الدوري الحديث هو أداة أساسية في مجال الكيمياء ويوفر إطاراً لتنظيم ودراسة العناصر الكيميائية. عن طريق فهم محددات وسلوك العناصر، يمكن للعلماء توجيه الأبحاث وتطوير المعرفة الكيميائية.
هيكل الجدول الدوري
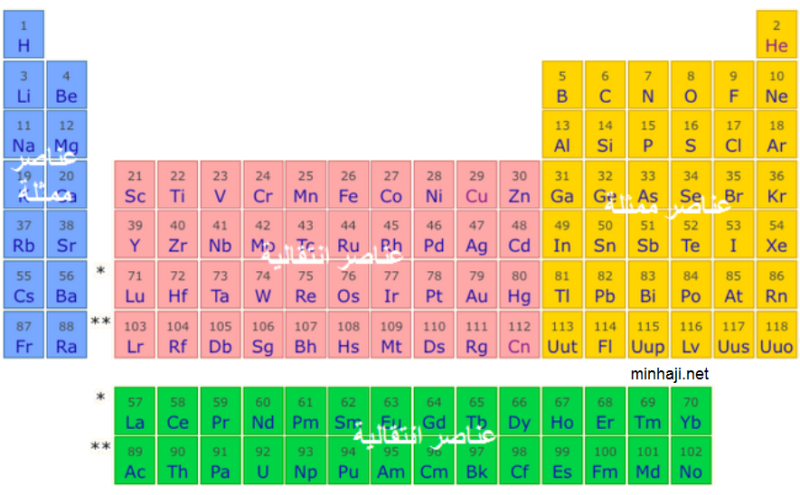
بعد ان ركزنا في الجزء الاول من المقال على تاريخ الجدول الدوري، سنتحدث هنا عن هيكل الجدول الدوري الحديث وتنظيمه. يتكون الجدول الدوري من الأعمدة (المجموعات) والصفوف (الدورات) ، وهو يعتبر ترتيبًا نظاميًا للعناصر الكيميائية وفقًا لخواصها المشتركة.
شاهد أيضًا: سيردالود دواعي الاستعمال للتخلص من الآم الظهر
العناصر والمجموعات الرئيسية
تنقسم العناصر في الجدول الدوري إلى مجموعات رئيسية تسمى أيضًا مجموعات القطبية أو العمودية. وتتكون المجموعات الرئيسية من 18 مجموعة مرقمة من 1 إلى 18 في الجدول. وتحتوي هذه المجموعات على العناصر التي لها صفات مشتركة وتتفاعل بنفس الطريقة الكيميائية. أهم المجموعات هي:
- مجموعة القلويات الأرضية (Group 2): تحتوي على العناصر من الباريوم (Barium) إلى الراديوم (Radium). تتميز هذه العناصر بكونها قلوياتية ومعدنية ومتفاعلة بشكل كبير مع الماء.
- مجموعة العناصر القلوية (Group 1): تحتوي على العناصر من الليثيوم (Lithium) إلى الفرانسيوم (Francium). تتميز هذه العناصر بكونها قلوياتية وقابلة للاشتعال عند ملامستها للهواء.
- مجموعة المعادن الانتقالية (Group 3-12): تحتوي على العناصر بين المجموعات القلوية والبنزينات على الجدول الدوري. تشتهر هذه العناصر بكونها معدنية ولها خواص متنوعة.
الدورة والعناصر الانتقالية
تنقسم الجدول الدوري أيضًا إلى صفوف أفقية تسمى الدورات. وتحتوي الدورات على العناصر التي تشترك في عدد الطبقات الإلكترونية. وهناك 7 دورات في الجدول الدوري وتُرقم من 1 إلى 7. الدورات الأكبر رقمًا تحتوي على عناصر أكبر وأكثر طاقة ، بينما الدورات الأصغر رقمًا تحتوي على عناصر أصغر وأقل طاقة.
عند النظر إلى الصفوف أو الدورات في الجدول الدوري، يمكننا ملاحظة وجود صفوف إضافية للعناصر المعادن الانتقالية. تمتد هذه الصفوف خارج هيكل الجدول الدوري الأساسي، مما يعكس الخواص المتنوعة للعناصر المعادن الانتقالية.
من خلال تنظيم العناصر في المجموعات والدورات ، يمكن أن يوفر الجدول الدوري للمنظور الشامل والمنظم للخصائص الكيميائية للعناصر. هذا يساعد العلماء والكيميائيين على فهم ودراسة الترابط الكيميائي والتفاعلات الكيميائية بشكل أفضل.
شاهد أيضًا: اختصارات تحليل الدم جدول رموز التحاليل الطبية ومعانيها
العناصر الرئيسية في الجدول الدوري
الجدول الدوري للعناصر هو ترتيب للعناصر الكيميائية وفقًا لخصائصها وتراكيبها الذرية. يحتوي الجدول الدوري على العناصر المعروفة التي تتكون من مجموعات وفصول وتوجد في فصائل معينة. هناك العديد من العناصر التي تعتبر أساسية في الجدول الدوري، وفي هذا القسم سنستعرض بعضها.
الهيدروجين
يُعتبر الهيدروجين أحد أهم عناصر الجدول الدوري. يتميز الهيدروجين بكونه العنصر الأول من حيث الترتيب الذري ويأتي في الفصيلة الأولى في الجدول الدوري. وهو أكثر عناصر الجدول الدوري انتشارًا في الكون، إذ يوجد بكميات كبيرة في الماء والمركبات الهيدروكربونية.
الليثيوم والصوديوم والبوتاسيوم
تعتبر العناصر الموجودة في المجموعة الأولى من الجدول الدوري من العناصر الهامة أيضاً. تشمل هذه العناصر الليثيوم والصوديوم والبوتاسيوم. تتميز هذه العناصر بكونها قابلة للانفصال بسهولة وتفاعلها القوي مع الماء.
البورون والكربون والنيتروجين
في المجموعة الثالثة من الجدول الدوري، توجد العناصر مثل البورون والكربون والنيتروجين. تلعب هذه العناصر أدوارًا حيوية في العديد من المركبات الكيميائية والمواد الحيوية. على سبيل المثال، يستخدم البور في إنتاج الزجاج والمبيدات الحشرية، بينما يتم استخدام الكربون في صناعة الأدوات والمواد الكربونية المكربنة.
الأكسجين والفلور والنيون
في المجموعة السادسة من الجدول الدوري، نجد العناصر مثل الأكسجين والفلور والنيون. يعتبر الأكسجين جزءًا أساسيًا في معظم المركبات العضوية ويستخدم في التنفس الخلوي والحرق. يعتبر الفلور مادة كيميائية شديدة السمية ويستخدم في العديد من التطبيقات الصناعية، بينما يُستخدم النيون في صناعة الأنوار والعلامات المضيئة.
بشكل عام، هذه العناصر هي بعض من العناصر الرئيسية في الجدول الدوري ولها دور هام في الكيمياء والعلوم بشكل عام. يُشجع القراء على استكشاف المزيد عن تلك العناصر وتأثيرها في العالم من حولنا.
شاهد أيضًا: جدول مذاكرة منظم لتحسن مستواك في اللغة الانجليزية في شهر
العناصر الانتقالية في الجدول الدوري
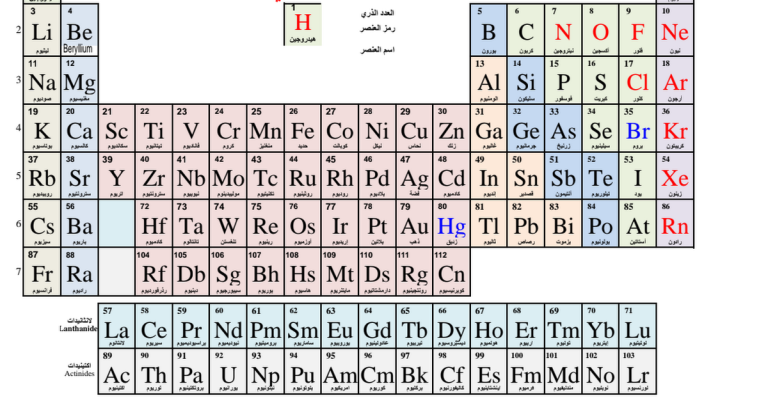
العناصر الانتقالية هي مجموعة من العناصر الموجودة في الجدول الدوري وتتميز بمستوى طاقة كهرونية مرتفعة تجعلها قابلة لتشكيل مستويات طاقة أعلى من ذلك النظام الأساسي للعنصر. تتميز هذه العناصر بخصائصها الفيزيائية والكيميائية المميزة التي تميزها عن باقي العناصر في الجدول الدوري.
الفلزات الانتقالية
الفلزات الانتقالية تشكل مجموعة مهمة من العناصر الانتقالية في الجدول الدوري. وتتميز هذه العناصر بالعديد من الخصائص الفيزيائية والكيميائية المميزة التي تجعلها مثيرة للاهتمام.
- الحديد (Fe): يعتبر الحديد واحدًا من أهم الفلزات الانتقالية، ويتميز بقوته وصلابته ومقاومته للتآكل. يستخدم الحديد على نطاق واسع في صناعة السيارات والمباني والأدوات المنزلية والمعدات الصناعية.
- النحاس (Cu): يشتهر النحاس بقدرته العالية على توصيل الكهرباء والحرارة. ويستخدم في العديد من التطبيقات بما في ذلك الأسلاك الكهربائية والأنابيب والأدوات الكهربائية.
- الزنك (Zn): واحد من العناصر الانتقالية الأكثر استخدامًا، يتم استخدام الزنك في المجالات المختلفة مثل الصناعة والبناء والإلكترونيات وحتى في صناعة البطاريات.
- الفضة (Ag): الفضة هي معدن ثمين ويتميز بلمعانه الجميل وخصائصه المميزة. يتم استخدام الفضة في صناعة المجوهرات والأدوات الطبية والأدوات الكهربائية.
- الذهب (Au): واحد من أشهر الفلزات الانتقالية والذي يُعرف بقيمته العالية وجماله. يستخدم الذهب في صناعة المجوهرات والأدوات الفاخرة والتطبيقات العلمية والتقنية.
تتميز الفلزات الانتقالية بمجموعة متنوعة من الاستخدامات والتطبيقات، وتساهم في تقدم الصناعة والتكنولوجيا. إن فهم خصائص واستخدامات هذه العناصر يمكن أن يكون له تأثير كبير على العديد من المجالات الحياتية.
شاهد أيضًا: عالم الرياضيات الخوارزمي سيرته الذاتية وانجازاته

